标题:实时定量荧光PCR技术在cDNA定量分析中的应用与优化
一、引言
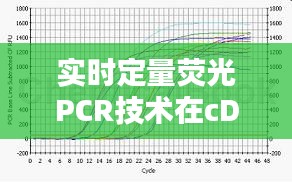
实时定量荧光PCR(Quantitative Real-Time PCR,qPCR)是一种高灵敏度的分子生物学技术,广泛应用于基因表达、病原体检测、基因突变分析等领域。在实时定量荧光PCR中,cDNA(互补DNA)的合成与定量是关键步骤。本文将介绍实时定量荧光PCR中cDNA的合成方法、定量原理以及优化策略。
二、cDNA的合成
- 反应体系
cDNA的合成主要包括逆转录反应和PCR反应两个步骤。逆转录反应的体系包括:模板DNA、逆转录酶、dNTPs、引物和缓冲液等。PCR反应的体系包括:cDNA模板、上下游引物、dNTPs、Taq酶和缓冲液等。
- 反应条件
逆转录反应条件:温度一般为42-55℃,反应时间一般为30-60分钟。
PCR反应条件:温度一般为94℃预变性,然后进行35-40个循环,每个循环包括94℃变性、55-60℃退火和72℃延伸。
三、定量原理
实时定量荧光PCR的定量原理基于荧光信号的强度与目标基因的拷贝数成正比。在PCR反应过程中,荧光信号的变化可以实时监测,从而实现对目标基因的定量。
- 标准曲线法
标准曲线法是实时定量荧光PCR中最常用的定量方法。通过绘制标准品浓度与荧光信号强度的标准曲线,可以计算出未知样品中目标基因的拷贝数。
- 相对定量
相对定量是指比较两个样品中目标基因的相对表达水平。通过比较两个样品的荧光信号强度,可以得出目标基因在两个样品中的相对表达量。
四、优化策略
- 引物设计
引物设计是实时定量荧光PCR成功的关键。设计引物时应注意以下几点:
(1)引物长度一般为18-25个碱基。
(2)上下游引物之间的距离应大于100个碱基。
(3)避免引物二聚体和发夹结构。
- 反应体系优化
(1)dNTPs浓度:dNTPs浓度一般为0.2-1.0μM。
(2)引物浓度:引物浓度一般为0.5-1.0μM。
(3)Taq酶浓度:Taq酶浓度一般为0.5-1.0U/μl。
- 反应条件优化
(1)退火温度:退火温度一般为55-60℃。
(2)延伸温度:延伸温度一般为72℃。
(3)循环次数:循环次数一般为35-40次。
五、结论
实时定量荧光PCR技术在cDNA定量分析中具有广泛的应用前景。通过优化引物设计、反应体系和反应条件,可以提高实时定量荧光PCR的灵敏度和准确性。本文对实时定量荧光PCR中cDNA的合成、定量原理和优化策略进行了详细阐述,为相关研究提供了参考。
文章字数:约950字
转载请注明来自衡水悦翔科技有限公司,本文标题:《实时定量荧光PCR技术在cDNA定量分析中的应用与优化》











 冀ICP备2023036310号-1
冀ICP备2023036310号-1